
联系我们
地址: 安徽省合肥市高新区望江西路5089号
邮编: 230026
电话: 0551-62391679
邮箱: iai@iai.ustc.edu.cn
《Science》子刊 | 人工智能研究院揭示环境偶联阿片药物耐受的神经机制
文章来源:本站原创 发布时间:2023-02-09 14:11:28 文章作者:本站编辑

阿片类药物(吗啡、芬太尼、美沙酮等)是临床上治疗疼痛最有效、使用最广泛的一类药物。值得关注的是,这类药物长期使用引起的镇痛耐受严重限制了阿片类药物的临床应用。大量基础和临床研究表明长期在固定环境中接受阿片类药物注射会导致镇痛耐受速度明显加快,这一现象被称为环境偶联阿片镇痛耐受(Associative opioid analgesic tolerance,AOAT),AOAT是阿片类药物耐受的重要组成形式,目前关于中枢调控AOAT的神经环路尚不清楚。

2023年2月8日,《Science Advances》期刊在线发表了题为“Coordinated activity of a central pathway drives associative opioid analgesic tolerance”的研究论文。该论文由合肥综合性国家科学中心人工智能研究院联合中国科学技术大学生命科学与医学部完成。在这项工作中,研究人员通过光遗传、化学遗传、钙成像和脑片电生理等方法,明确了腹侧海马的谷氨酸能神经元→背内侧前额叶皮层的胆囊收缩素能神经元→基底外侧杏仁核的谷氨酸能神经元这条神经环路在AOAT中的重要作用。Science Advances期刊同期还对该工作以“Pavlovian-conditioned opioid tolerance”为题进行了长篇焦点评论(https://www.science.org/doi/10.1126/sciadv.adg6086)。国际上著名的《New Scientist》(新科学家)杂志也对该工作以“Newly found brain pathway could be key to reducing opioid addiction”进行了详细报道。
研究人员首先通过在固定的特殊环境中连续五天对小鼠注射吗啡,发现特殊环境中小鼠的吗啡镇痛耐受的速度明显快于鼠笼中小鼠的耐受速度,从而成功构建了AOAT模型小鼠,再通过全脑c-fos染色发现吗啡与特殊环境偶联后会导致腹侧海马(Ventral hippocampus,vHPC)、背内侧前额叶皮层(Dorsomedial prefrontal cortex,dmPFC)和基底外侧杏仁核(basolateral amygdala,BLA)中的神经活动明显增加。同时,通过神经元损毁、行为学和c-fos染色相结合初步判定vHPC→dmPFC→BLA神经环路可能参与调控AOAT。
随后,研究人员使用病毒追踪和脑片电生理手段,发现vHPC→dmPFC的谷氨酸能神经元被吗啡关联的特殊环境激活,化学遗传特异性激活/抑制GluvHPC→dmPFC轴突末端可以模拟/降低AOAT的发展,而抑制vHPC→BLA投射不影响AOAT的发展。接下来,研究人员对dmPFC→BLA的投射在AOAT中的作用进行了研究,通过化学遗传和钙成像发现dmPFC→BLA投射神经元在AOAT中发挥重要作用。并且通过RNA测序、神经环路示踪发现dmPFC→BLA具有胆囊收缩素(cholecystokinin,CCK)能投射神经元,而CCK正好是脑内最有效的内源性抗阿片肽。化学遗传特异性激活/抑制CCKdmPFC→BLA轴突末端可以模拟/抑制AOAT的发生发展。最后,研究人员通过药理学、免疫荧光染色和化学遗传等手段,进一步发现dmPFC→BLA的CCK能投射神经元通过释放CCK8s作用于CCK2受体从而拮抗BLA中μ-阿片受体,最终导致了AOAT发生。
综上,这项研究解析了环境偶联阿片耐受的神经环路及分子机制,加深了我们对阿片类药物耐受神经机制的认识,为临床上治疗阿片耐受、成瘾和滥用提供了潜在的治疗靶点。
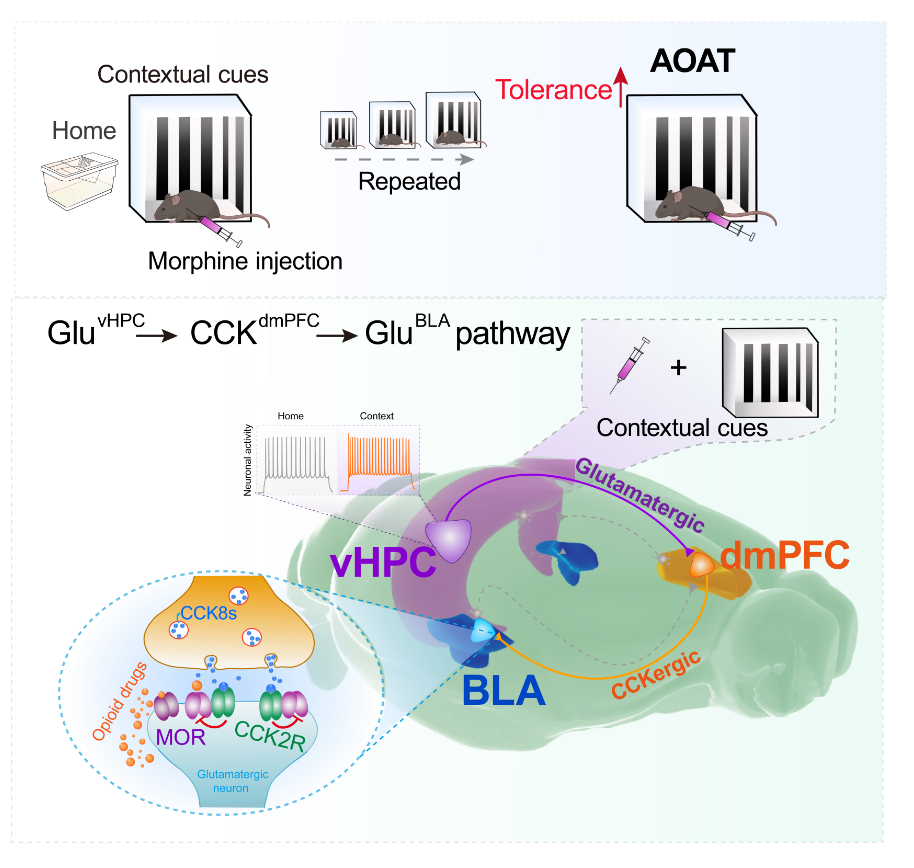
图注:环境偶联阿片耐受的神经环路示意图
该项研究由中国科学技术大学博士后侯熠文和中国科学技术大学特任副研究员、合肥综合性国家科学中心人工智能研究院实验动物平台脑认知与脑功能行为学平台邹桂昌副研究员具体完成,中国科学技术大学生命科学与医学部、合肥综合性国家科学中心人工智能研究院的熊伟教授为论文的唯一通讯作者。该项工作得到中国科学院、国家自然科学基金委员会、科技部、教育部等部门的资助。
文章链接:http://www.science.org/doi/10.1126/sciadv.abo5627.





